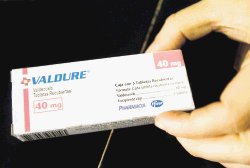
 |
Venta suspendida
Tras una serie de críticas, la venta y comercialización del fármaco "Valdure", contra dolores de la artritis, fue suspendida ayer en Estados Unidos. No se descarta una medida similar en Costa Rica.
Rafael PACHECO/Al Día
|
Alerta por pastilla para artritis
La venden aquí como "Valdure" Pablo GUERÉN CATEPILLÁN
pgueren@aldia.co.cr
El análgésico "Bextra" utilizado por enfermos de artritis fue retirado ayer del mercado estadounidense y en San José, el Ministerio de Salud analizará hoy qué medida tomar. En el país, ese medicamento es conocido como "Valdure".
La alerta surgió tras conocerse un informe de la Dirección de Alimentos y Fármacos de Estados Unidos (FDA, por sus siglas en inglés), el cual ordenó a Pfizer, compañía que produce el medicamento, retirarlo del mercado norteamericano por los riesgos que entraña su consumo.
Según la FDA, se ha detectado que dicho analgésico aumenta el riesgo de sufrir ataques cardíacos y de apoplejía, y, por otro lado, mantiene un perfil beneficio-riesgo "desfavorable".
La Ministra de Salud, María del Rocío Sáenz, convocó para hoy con carácter de urgente a una sesión extraordinaria del Comité de Inscripción de Medicamentos, órgano que deberá decidir si el "Valdure", puede seguir siendo comercializado en el país.
La ministra no descartó la posibilidad de sacarlo del mercado nacional.. En Estados Unidos, la firma Pfizrer la mayor empresa elaboradora de medicamentos del mundo, lo retiró ayer mismo de circulación. Lo mismo ocurrió en Europa.
En diciembre, la FDA había advertido sobre el mismo medicamento, la existencia de un riesgo asociado de reacciones cutáneas graves "potencialmente fatales".
Estas valoraciones no son compartidas por Pfizer, según confirmó ayer Eva Berkovics, gerente de Asuntos Corporativos del laboratorio en Costa Rica. Asunto delicado"El asunto es delicado. Actuaremos con urgencia, pero debemos seguir el debido proceso. Tan pronto tomemos una decisión se lo comunicaremos a la ciudadanía", dijo la Ministra Sáenz.
Berkovics confirmó que ya se le pidió una cita al Ministerio de Salud "para discutir los alcances de lo decidido por la FDA".
|

